- 2020. március 30.
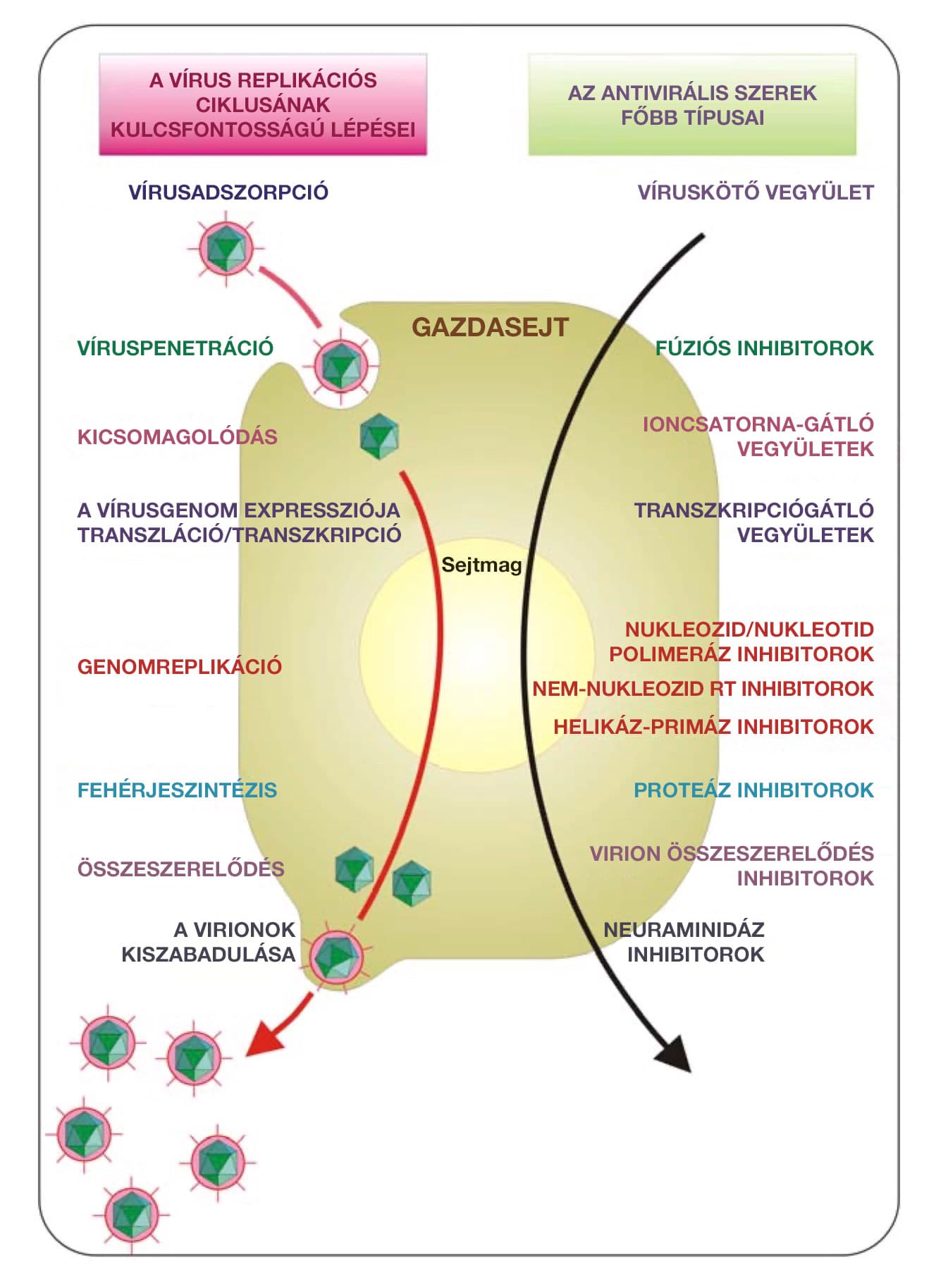
Hogyan fejti ki virucid hatását a nanoezüst?
„Az ezüst nanorészecskék mint lehetséges antivirális ágensek” címmel közöl review tanulmányt a Molecules című folyóirat: a cikk hétféle vírus példáján mutatja be részletesen, hogy miként fejtik ki vírusellenes hatásukat a nanoezüst részecskék.
Az eddig elvégzett tudományos vizsgálatok egyértelműen igazolták, hogy a nanoezüst részecskék rendkívül hatékonyak a különféle vírusok elpusztításában. Egyaránt történtek vizsgálatok a humán immundeficiencia-vírus 1-es típusával (HIV-1), a herpes simplex vírus 1-es típusával (HSV-1), a respiratorikus szinciciális vírussal (RSV), a majomhimlő vírussal (MPV), az influenza vírussal, a Tacaribe vírussal (TCRV), valamint a hepatitis B vírussal (HBV).
Mindez azért fontos, mert a vírusok ellenállóvá válhatnak a hosszabb időn át alkalmazott hagyományos vírusellenes kezelésekkel szemben, ezért nagy szükség van olyan új antivirális terápiákra, amelyek akkor is alkalmazhatóak, amikor a hagyományos antivirális kezelések már nem járnak eredménnyel. A fém nanorészecskék alkalmazása az antivirális terápiák fejlesztésében is új távlatokat nyit: a fémek a vírusok többféle célpontját is képesek megtámadni, így a hagyományos antivirális terápiákkal összehasonlítva csökken a kezeléssel szembeni vírusrezisztencia kialakulásának kockázata.
Hogyan fejti ki virucid hatását a nanoezüst?
Stefania Galdiero és munkatársai mind a hét említett vírus esetében részletesen leírják, hogy az ezüst nanorészecskék milyen mechanizmus útján képesek a vírusok semlegesítésére.
Humán immundeficiencia-vírus 1 (HIV-1)
Az AIDS betegség kialakulásáért felelős humán immundeficiencia-vírus 1-es típusával (HIV-1) végzett tudományos vizsgálatok azt mutatták, hogy az ezüst nanorészecskék leginkább a HIV vírus gp120 glikoprotein meghatározott részeihez kötődnek hozzá, így képesek arra, hogy gátolják a HIV-1 fertőzési ciklusának kezdeti lépéseit.
A kutatók azt is kimutatták, hogy az ezüst nanorészecskék a gp120-CD4 interakció gátlásán keresztül gátolják a vírus CD4 sejtekbe történő belépését (a CD4 sejtek a vírusok elpusztításában aktívan résztvevő úgynevezett segítő T-sejtek, amelyek a HIV vírus célpontjait jelentik).
A kutatás azt is felderítette, hogy az ezüst nanorészecskék nem feltétlenül csak a gp120-hoz képesek kötődni, hanem a HIV vírus egyéb fehérjéit is gátolhatják, illetve csökkenthetik a HIV-re jellemző reverz vagy provirális transzkripciós rátákat azáltal, hogy közvetlenül a HIV vírus RNS vagy DNS molekuláihoz kötődik. (A HIV genomja egyszálú RNS, a vírusrészecskét lipidburok veszi körbe. Miután behatolt a gazdasejtbe, az RNS-genomot a vírus reverz transzkriptáz enzimje átírja kettős szálú DNS-sé, amely aztán beintegrálódik a gazdasejt saját DNS-ébe.)
Az ezüst nanorészecskék virucid hatását a sejtmentes és a sejthez kötött HIV-1 vírusok esetében is egyaránt igazolták. A HIV fertőzőképessége elmúlt azt követően, hogy az izolált vírust ezüst nanorészecskéknek tették ki – írják a szerzők.
Herpes simplex vírus 1 (HSV-1)
A kétszálú DNS-sel rendelkező herpeszvírusok közé tartozó herpes simplex vírus 1 (HSV-1) nanoezüstre történő reakcióit a következőképpen írták le a kutatók.
A vírus ötféle glikoproteint (gB, gC, gD, gH és gL) használ a megfertőzni kívánt sejtekbe történő belépéshez.
Az elvégzett vizsgálatok azt mutatták, hogy az ezüst nanorészecskék meggátolják, hogy az említett glikoproteinjeivel a sejtekhez kötődjön, így a vírus már eleve meg sem tudja fertőzni a kiszemelt sejteket. Kiderült az is, hogy a nanorészecskék a vírus sejtről sejtre történő terjedését is képesek meggátolni.
Respiratorikus szinciciális vírus (RSV)
A respiratorikus szinciciális vírus egy egyszálú RNS-t tartalmazó vírus, amely a tüdő és a légutak epiteliális hámját fertőzi meg, súlyos légzési problémákat okozva ezzel főként a gyermekek és az idősek körében. A vírus ellen nem létezik sem vakcina, sem pedig hatásos gyógyszer, így alapvetően fontos lenne, hogy a jövőben kifejlesztésre kerüljön valamilyen új gyógyszer.
A nanoezüst-részecskék és a vírusrészecskék közötti interakció transzmissziós elektronmikroszkóppal készített felvételei azt mutatták, hogy a szarvasmarhaszérum-albuminnal (BSA) bevont nanorészecskék kapcsolatba léptek ugyan a vírussal, de a kötődés nem mutatott semmilyen szabályos térbeli mintázatot. A polivinil-pirollidonnal (PVP) bevont ezüst nanorészecskék szintén kapcsolatba léptek a vírussal, és a kötődés ebben az esetben szabályos térbeli mintázatot mutatott, ami arra utal, hogy ezek a nanorészecskék képesek az RSV virionok felszínén egyenletes eloszlásban jelen lévő G-proteinekhez kötődni. A BSA és PVP bevonatokra a nanoezüst-részecskék toxicitásának csökkentése miatt volt szükség.
A nanorészecskék vírusgátló hatékonyságát immunfluoreszcens mikroszkóppal határozták meg: a szakemberek azt tapasztalták, hogy a BSA-val bevont nanorészecskék nem gátolták az RSV fertőzés sejtekben történő terjedését, a PVP-ben bevont részecskék viszont 44 százalékkal csökkentették a vírus sejtekben történő terjedésének ütemét. A gátlás a kutatók szerint a G-proteinekhez történő kötődés következtében jön létre, ami megakadályozza a vírust abban, hogy bejusson a sejtekbe.
Hepatitis B vírus (HBV)
A hepatitis B vírusok részben kétszálú DNS-t tartalmaznak, amelyet egy lipidburok vesz körbe. A HBV a májsejteket (hepaticiták) támadja, és amint bejutott a sejtbe, a vírusrészecskék a sejtmag felé veszik az irányt, ahol a vírusgenom kovalensen zárt cirkuláris DNS-sé (cccDNS) alakul.
A jelenleg rendelkezésre álló antivirális szerek elsődlegesen a vírus polimeráz reverz transzkriptáz enzimet célozzák: ezeknek a szereknek a hatásossága ugyan bizonyított, a velük szemben rezisztens HBV törzsek száma azonban meredek emelkedést mutat, korlátozva a szerek alkalmazhatóságát.
Kutatók egy csoportja monodiszperz ezüst nanorészecskék azon képességét elemezte, hogy milyen arányban képesek gátolni a HBV szaporodóképességét. A vizsgálatban többféle méretű nanorészecskét is alkalmaztak: a 800 nanométeres részecskék (Ag800Ns) túlságosan toxikusnak bizonyultak ahhoz, hogy antivirális hatóanyagként alkalmazzák őket, a 10 és 50 nanométeres részecskék (Ag10Ns, Ag50Ns) viszont már alkalmazhatóak voltak, hiszen minimális toxicitást mutattak abban a koncentrációban, amelyre a vírusreplikáció gátlásához szükség volt.
A kutatók beszámolója szerint mindkét mérettípusú nanorészecske jelentős antivirális aktivitást mutatott: az Ag10N esetében ez a vírusreplikáció 38 százalékos gátlását jelentette 5 µM-os koncentrációnál és 80 százalékos gátlást 50 µM-os koncentrációnál, az Ag50N esetében pedig a vírusreplikáció 53 százalékos gátlását lehetett megfigyelni 5 µM-os koncentrációnál és 92 százalékos gátlást 50 µM-os koncentrációnál.
A kutatók feltételezik, hogy az ezüst nanorészecskék azáltal gátolják a HBV replikációhoz szükséges RNS molekulák és extracelluláris virionok termelődését, hogy hozzákapcsolódnak a vírus kétszálú DNS-éhez és/vagy közvetlenül kapcsolódnak a vírusrészecskékhez.
Influenzavírus
A minden évben ismétlődő járványokat okozó influenzavírus egy rendkívül fertőzőképes kórokozó, amelynek helikális kapszidjában 8 darab RNS szegmens van jelen. A kapszidot egy lipidburok veszi körbe, amelyen 2-féle, tüskeszerűen kiálló glikoprotein található,a hemoagglutinin A (HA) és a neuroaminidáz (NA).
A vírus a hemoagglutinin A és a glikoproteineken jelenlévő sziálsav (SA), valamint a megfertőzni kívánt sejtek plazmamembránja között létrejövő interakció során képes hozzákötődni a megfertőzni kívánt sejtek plazmamembránján jelenlévő lipidekhez, amit a vírus sejten belülre juttatását végző receptormediált endocitózis követ.
A kutatók az influenzánál nem ezüst, hanem arany nanorészecskéket alkalmaztak, amelyeket sziálsav-terminált glicerol dendronnal láttak el azzal a szándékkal, hogy meggátolják a vírus plazmamembránhoz történő kötődését.
Az arany nanorészecskékből a 2 nanométeres és a 14 nanométeres verziókat próbálták ki, és azt találták, hogy a 2 nanométeres változat nem volt hatással a hemoagglutinációra, a 14 nanométeres változat viszont sikeresen meggátolta a vírusrészecskék sejtmembránhoz történő kapcsolódásának folyamatát (nanomoláris tartományú koncentrációban adva).
Majomhimlő vírus (MPV)
A variola vírusra hasonlító majomhimlő vírus a nem humán emberszabásúak több faját is képes megbetegíteni, emellett azonban az emberre is veszélyes, és a feketehimlőhöz hasonló, életveszélyes tüneteket produkál.
A kutatások során többféle méretű ezüst nanorészecskével is próbálkoztak, amelyeket 12,5-től 100 mikrogram/milliliterig terjedő koncentrációkban adagoltak a vírusokhoz.
Az eredmények azt mutatták, hogy a 25 nanométeres, poliszacharid bevonattal rendelkező ezüst nanorészecskék és a poliszacharid bevonattal nem rendelkező, 55 nanométeres ezüst nanorészecskék szignifikáns, dózisfüggő gátlást gyakoroltak a majomhimlő vírusára, megakadályozva benne a vírust, hogy plakkokat hozzon létre. (Ennek pontos mechanizmusát egyelőre még nem vizsgálták meg.)
Tacaribe vírus (TCRV)
Az Arenaviridae családba tartozó Tacaribe vírus ugyan nem egy humán patogén, viszont közeli rokonságban olyan emberi patogénekkel (Junin és Guanarito vírusok), amelyek súlyos betegségeket képesek kiváltani az embereknél (például vérzéses lázat). A Tacaribe vírus ezért tökéletes modellvírus ahhoz, hogy az emberi fertőződés veszélye nélkül vizsgáljuk rajta a másik két, emberre is veszélyes vírus tulajdonságait és viselkedését.
A kutatók vizsgálataikban kétféle ezüst nanorészecskét alkalmaztak, egy poliszacharid borítás nélküli, és egy poliszacharid borítással rendelkező részecskét.
Azt tapasztalták, hogy amikor a vírus ellen 50 μg/ml, 25 μg/ml és 10 μg/ml koncentrációban vetették be a 10 nanométer nagyságú, borítás nélküli ezüst nanorészecskéket, mindhárom alkalommal jelentős csökkenés volt tapasztalható a vírustiterben.
A poliszacharid borítással rendelkező ezüst nanorészecskék esetében hasonló eredményeket tapasztaltak, bár csak kisebb titercsökkenéssel, viszont alacsonyabb toxicitással.
A kutatók feltételezik, hogy az ezüst nanorészecskék a vírus membrán-glikoproteinjeihez képesek kapcsolódni, és így gátolják a vírus szaporodását.